整形外科初期研修レジデント後記 島津 和仁
初期研修医2年目の選択科目として1ヶ月間の整形外科ローテーションを希望しました.先生方は,お忙しい中,熱意とエビデンスを伴ったご指導をしてくださいました.整形外科を希望した理由としては,救急外来で診る外科疾患の多くが整形外科疾患であり,手術だけではなく初期対応を学ぶ上でも研修すべき科であることは自明の理です.また今回の症例として手術にご一緒させていただいた骨巨細胞腫をはじめ,医学的にも重要である腫瘍性疾患についてもご指導いただけたことに大変感謝しております.先生方にご教授いただいた知識と経験を今後の診療に活かせるよう,今後も研鑽を積ませていただきます.ご指導いただきましたこと,心から感謝を申し上げます.
平成28年度臨床研修医 島津 和仁
左脛骨近位部の骨巨細胞腫に対し拡大掻爬術,焼灼,およびフェノール処置を施行した一例
はじめに
骨巨細胞腫(giant cell tumor of bone; GCT)は骨幹端を好発部位とし,20〜40代を好発年齢とする良性腫瘍である.原発性骨腫瘍の5%と比較的稀な骨腫瘍だが,生検された良性腫瘍の中では20%を占める.好発部位としては90%が骨端部に発生する.また,良性腫瘍ではあるが局所再発率が50%程度と高く,遠隔転移も2〜3%に併発するため,様々な治療法が検討されている.本症例は脛骨近位部のGCT(Campanacci grade Ⅱ)に対して拡大掻爬術+フェノール処置+人工骨移植+プレート固定を施行した一例である.
症例
36歳男性.1ヶ月前から持続する右膝関節痛を主訴にA病院受診.X線画像では右脛骨近位部骨幹端から骨端に透亮像あり,MRI脂肪抑制で充実性腫瘍(T1低信号,T2およびDWIで高信号)が認められ,当院へ紹介受診となった.右脛骨近位端GCT(Campanacci grade Ⅱ)の臨床診断となり,転移は認められず,拡大掻爬術が施行された.
身体所見
右膝関節:運動時痛および階段昇降で痛みの増強と外側関節裂隙に圧痛・腫脹を認めた.
画像所見
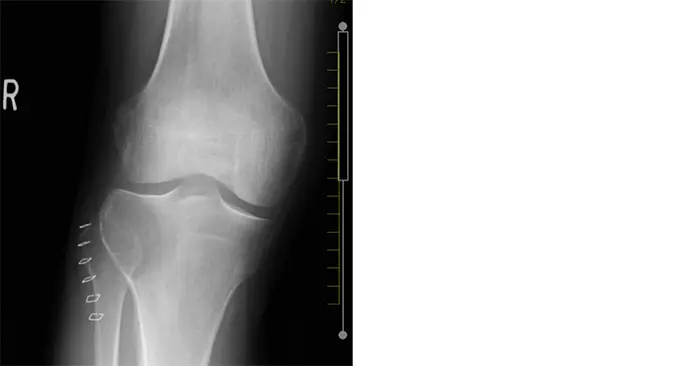
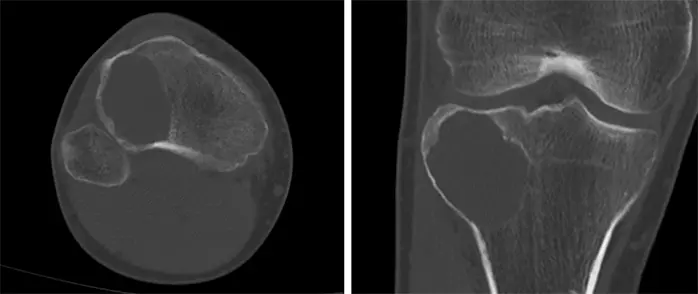
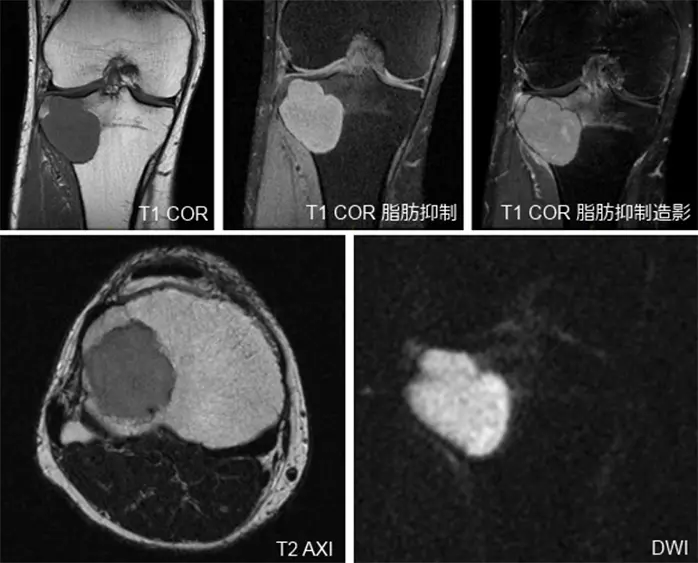
受診時の膝関節X線画像では,右脛骨の骨幹端から骨端に及ぶ骨透亮像が認められ(Figure 1),単純CTで,同様に膨張性に発育する44x40x37mmの溶骨性病変が認められ,関節面まで1mm程度のところまで進展している.硬化縁はなく,内部は筋肉より低濃度で石灰化は認められない(Figure 2).また,右膝関節のMRIでも右脛骨近位外側,骨幹端から骨端線を越えて骨端まで及ぶ44×40×36mm大の病変を認める.内部はT1強調像で低信号,T2強調像で筋肉より高信号でほぼ均一.周囲に軽度の骨髄浮腫を伴い,拡散強調像では高信号を呈している.脂肪抑制T1強調像で高信号であるが,造影後との差分画像で全体が増強されている.以上の所見よりGCTが疑われる(Figure 3).
手術記録
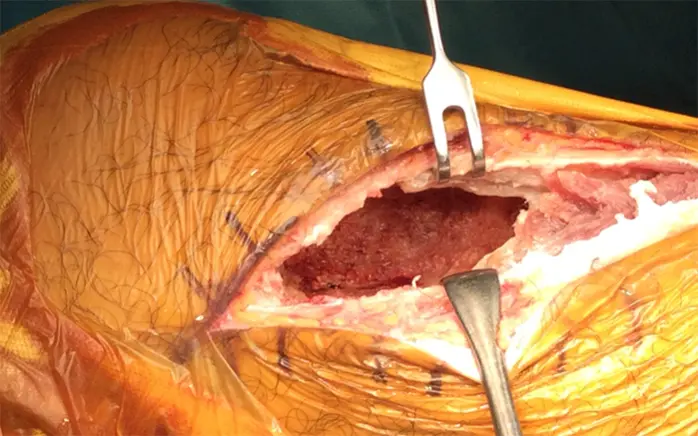
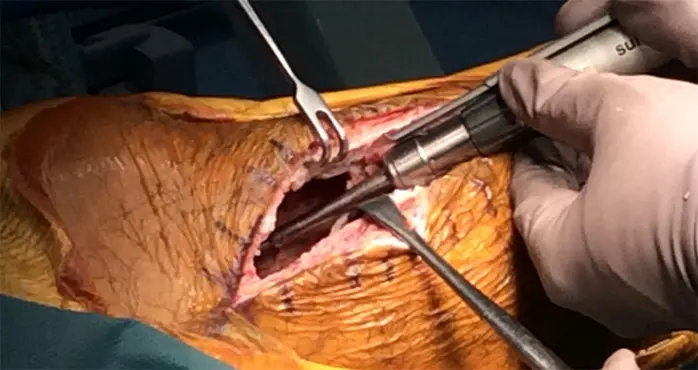
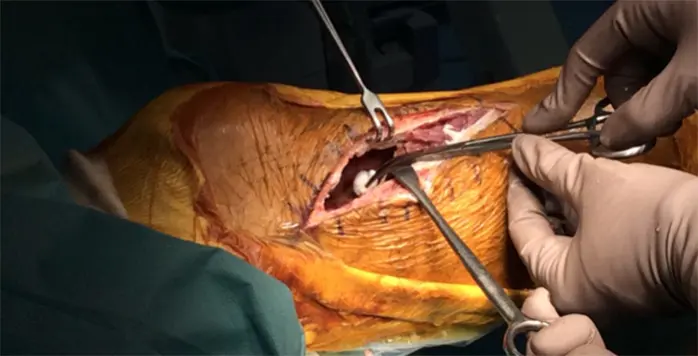
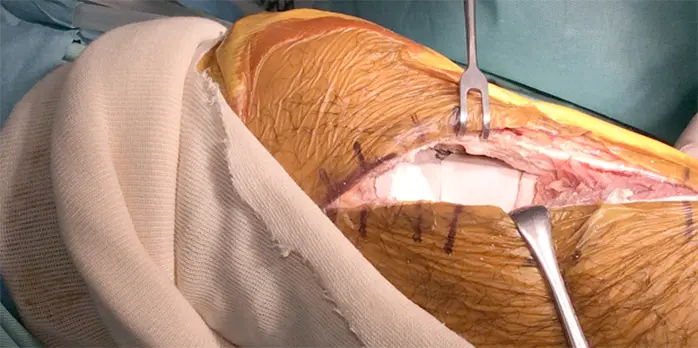
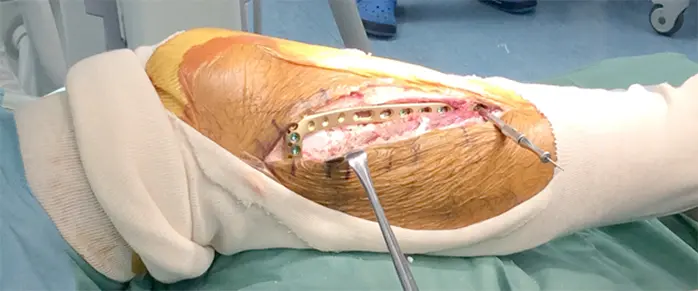
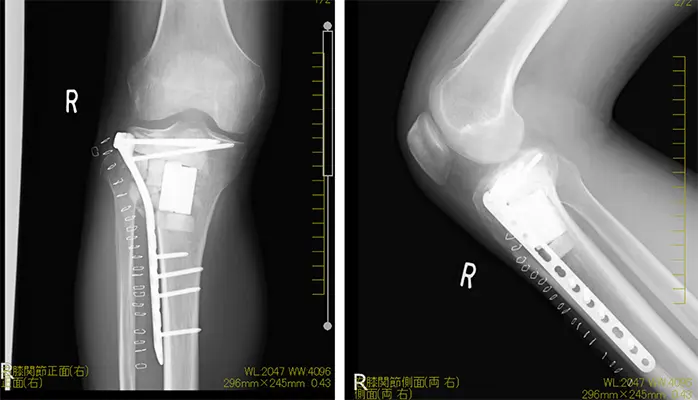
拡大掻爬術+フェノール処置+人工骨移植+プレート固定施行.生検時の皮切を利用し,前外側皮切で展開.脛骨外側を大きく開窓した後に周囲骨髄が出るまで掻爬を施行 (Figure 4).次にエアトームを用いて拡大掻爬後に熱焼却・フェノール処置を施行(Figure 5, 6).イメージ下に十分掻爬ができたことを確認後に,気孔率の高いOSferion®顆粒を軟骨下骨に充填後,下支えをするようにOSferion®ブロックを留置.その上で同OSferion®ブロックを支えるように気孔率60のOSferion®ブロックを充填(Figure 7).次にシンセス社製外側用Locking Compression Plate (LCP)を設置(Figure 8).近位軟骨下骨にrafting screwとしてlocking screwを4本挿入,遠位にもlocking screwを4本挿入固定.骨内にアミカシン5A注入,ドレーンを留置し追層縫合,閉創し,手術終了となった.術直後に正面像および側面像を撮影し,明らかな異常認められないことを確認した(Figure 9).
病理結果
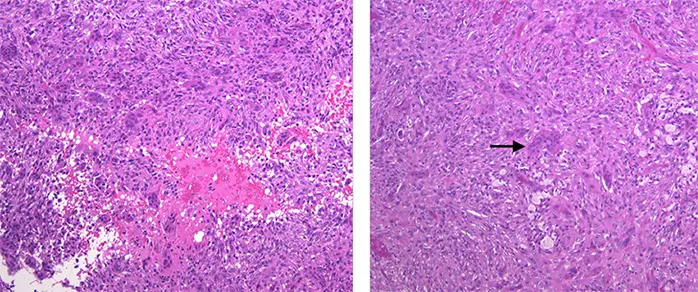
右側脛骨近位から採取された生検検体の脱灰標本を作製.標本は破骨細胞様の多核巨細胞や卵円形から紡錘形の単核細胞の密な増生で構成されており,GCTと診断された(Figure 10).
考察
本症例は36歳男性の持続する右膝関節痛を主訴に診断された右脛骨近位部GCT(Campanacci grade Ⅱ)に対して拡大掻爬術+フェノール処置+人工骨移植+プレート固定を施行した一例である.脛骨の骨幹端から骨端に及ぶ骨内病変は,良性腫瘍では内軟骨腫,孤立性骨嚢腫,動脈瘤様骨嚢腫,悪性では軟骨肉腫や骨肉腫を鑑別する必要がある.また年齢的には骨腫瘍として骨線維肉腫,軟骨肉腫などが鑑別としてあげられる.病理学的のみの観点では,他の多核巨細胞や破骨細胞に富んだ腫瘍として,動脈瘤様骨嚢腫,非骨化性線維腫,線維性骨皮質欠損,多核巨細胞に富む骨肉腫,軟骨芽細胞腫を鑑別にあげる必要がある.
本症例は若年の骨内に限局した腫瘍で,病的骨折も認められていないため一般的な外科的治療法として拡大掻爬術が選択された(Lackman et al. 2005)(Wang et al. 2006).それ以外の外科的療法としては切除術がある.切除術は掻爬術より再発率が低いが,再建による機能障害の可能性が高くなる.化学療法としては近年では抗RANKL (Receptor Activator of Nuclear factor Kappa B Ligand) 抗体であるdenosumabの投与が良好な成績を収めているが,外科的療法に比べ長期経過での診療が必要となる.
掻爬部への骨セメントの充填は,化学反応の熱により残存腫瘍が死滅するため局所再発率が低下し,さらに早期からの荷重が可能となる長所があるが,将来的に変形性関節症の発生が問題となる(Sobti et al., 2016).本症例では将来的な変形性関節症の発生予防のため骨セメントは用いず,OSferion®を使用しているが,これは主成分として多孔質セラミックスの一種であるβ-リン酸三カルシウム(β-TCP)を含有している.β-TCPはα-リン酸三カルシウム(α-TCP)に比べ,圧縮強度が海綿骨に近く生体親和性が高いため,数年で吸収され自家骨へ置換される.他の多孔質セラミックスとしてはハイドロキシアパタイト(HA)があり,高い気孔率を保有するが,生体への吸収効率はβ-TCP に劣る(Aizawa and Furuzono. 2012).本症例では,30代の男性であることを考慮し,荷重のかかる部位に自家骨移植を施行する代わりに侵襲性およびQOLを考慮しβ-TCPにより再建した(Murakoshi et al., 2012).
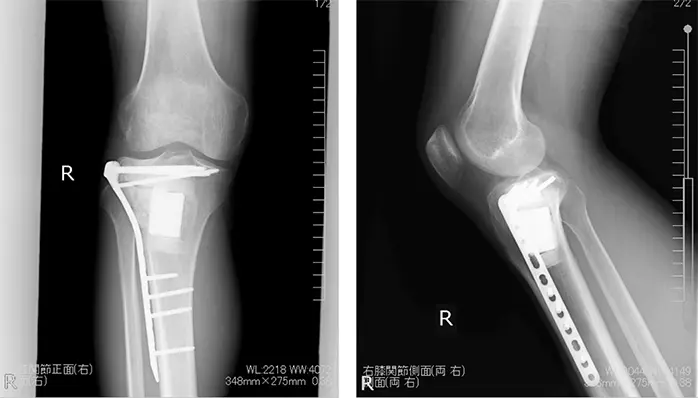
単純な掻爬術の局所再発率は約50%とされ,75%は2年以内,残りの25%が5年以内に再発する.再発予防のために健常組織まで掻爬する拡大掻爬術が行われる.さらに凍結療法,フェノール処置,アルコール処置,熱焼却などの補助療法を行うことで,再発率が低下すると報告されている.GCTの悪性化は稀であり,悪性化する原因は通常は放射線被爆である(Kadowaki et al. 2012).組織学的には骨肉腫が最多だが,悪性線維性組織球腫や骨線維肉腫への悪性化も認められている(Heffernan et al. 2007).機能評価などの理由がない限りは5年以上のfollow-upは必要ないが,局所再発した患者に対しては肺転移を考慮し胸部CTによる精査が望ましい.当症例においては,術後1日目から車椅子移乗,3日目から10kg荷重歩行.術後2ヶ月で全荷重歩行となり,歩行時の疼痛も認められていない.半年以上経過した現在でも明らかな再発は認められず,人工骨も置換されており,現時点までの経過は良好である(Figure 11).
引用文献
Aizawa M and Furuzono T. Artificial Material (Inorganic Material). Journal of Artificial Organs. 2012; 41(3).
Eckardt JJ and Grogan TJ. Giant cell tumor of bone. Clin Orthop Relat Res. 1986 Mar;(204):45-58.
Heffernan E, O’Sullivan P, Adibeig M, Louis L, et al. Primary malignant transformation of giant cell tumor of bone. European Journal of Radiology Extra. 2007; 62(3): 89-93.
Kadowaki M, Yamamoto S and Uchio Y. Late malignant transformation of giant cell tumor of bone 41 years after primary surgery. Orthopedics. 2012;35(10):e1566-e1570.
Kivioja AH, Blomqvist C, Hietaniemi K, Trovik C, et al. Cement is recommended in intralesional surgery of giant cell tumors: a Scandinavian Sarcoma Group study of 294 patients followed for a median time of 5 years. Acta Orthop. 2008; 79(1):86.
Lackman RD, Hosalkar HS, Ogilvie CM, et al. Intralesional curettage for grades II and III giant cell tumors of bone. Clin Orthop Relat Res 2005; 438:123.
Murakoshi T and Kobayashi S. Characterization of mechanical properties and bioactibity of hydroxyapatite / β-Tricalcium phosphate composites. Journal of the Japan Society for Composite Materials. 38, 3(2012),116-126.
Sobti A, Agrawal P, Agarwala S and Agarwal M. Giant Cell Tumor of Bone - An Overview. Arch Bone Jt Surg. 2016 Jan; 4(1): 2–9.
Wang HC, Chien SH, Lin GT. Management of grade III giant cell tumors of bones. J Surg Oncol. 2005; 92:46.




