整形外科初期研修レジデント後記 小田木 さやか
整形外科にて1ヶ月間研修させていただきました。
今まで、救急外来等で骨折や脱臼を診てきましたが、初期対応のみで治療に関わったことはほとんどありませんでした。整形外科の研修では、実際に骨折等の周術期管理や術式等を学ぶことができました。毎日、手術に参加させていただき、充実した日々を過ごすことができました。
病棟では、毎朝回診に参加し、術後処置や、牽引等整形外科特有の処置を学ぶことができました。また、時間のある時には、夕診なども見学させていただき、骨折の徒手整復・保存加療も見学させていただくことができました。一か月間という、短い研修期間でしたが、先生方が熱心に指導してくださりとても有意義な研修をさせていただきました。整形外科研修で学んだことを今後の診療に活かしていきたいと思います。
平成25年度臨床研修医 小田木 さやか
症例
94歳 女性
主訴
右臀部腫瘤
現病歴
2014年3月頃より右臀部の硬結を認め、急激に増大してきたため、近医整形外科を受診。右臀部に20cm×10cm程度の弾性硬の腫瘤を認め、当院当科紹介となる。
外来にて針生検を施行し、MFH(malignant fibrous histiocytoma;悪性線維性組織球腫)の診断であったため、5月9日手術目的に当科入院となる。
既往歴
骨粗鬆症、高血圧、緑内障、白内障、腰痛症
内服薬
ブロプレス、ワンアルファ、ネキシウム、ウリトス、アクトネル、エディロール、セレコックス
入院前ADL
押し車にて自立歩行可能。
入院時現症
右臀部に腫脹・熱感・発赤・圧痛・可動性を認める硬結をふれた。
検査所見
L/D
WBC 45.7X100 /μl, RBC 326X104 /μl, Plt 24.2X104 /μl, Hb 10.0 g/dl, Ht 30.6 %, HbA1c 5.5%, CRP 0.03 mg/dl, AST 18 IU/l, ALT 8 IU/l, LDH 162 IU/l, ALP 150 IU/l, γ-GTP 11 IU/l, TP 6.3 g/dl, Alb 3.8 g/dl, BUN 21.7 mg/dl, Cre 1.08 mg/dl, Na 139 mEq/l, K 4.6 mEq/l, Cl 104 mEq/l, CEA 3.6 ng/ml, CA19-9 8.1 U/ml, SCC 0.8ng/ml, CA125 14.0 U/ml, 可溶性IL-2-R 427 U/ml, PT 101 %, PT-INR 0.99, APTT 24.5 sec, D-dimer 1.6 μg/ml
胸部X-p,CT
明らかな腫瘤・結節陰影なし
MRI
右臀部に境界明瞭な37X31、48X28、30X16mmの結節性腫瘤を認め、T1低信号、T2低信号,一部高信号、diffusionで周囲組織は高信号に描出され浮腫性変化が認められる。
針生検
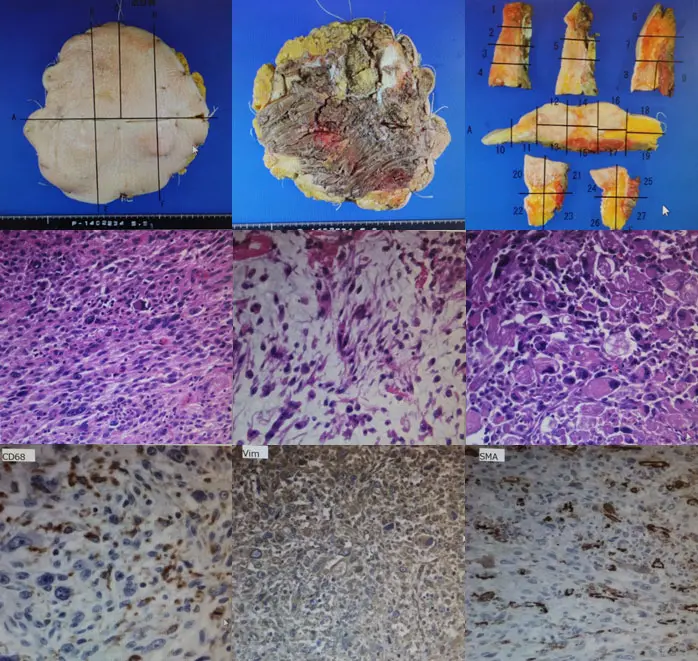
核の腫大、大小不同、多核化、多形性などの異型性を示す紡錘形細胞の不規則束状の増生を認め、多くはビメンチン免疫染色に陽性、一部で平滑筋アクチンやS-100蛋白、CD68が陽性であった。
入院後経過
本症例は高悪性度のMFHであるため、一般的には化学療法の適応であるが、高齢であるため広範切除のみを施行した。
術前切除縁設定は腫瘍より縦横方向に3cm、深部は筋膜に1cmほど筋肉をつけて広範切除とした。
手術経過
皮膚より触れる腫瘤の辺縁から約3cmの範囲で皮切を加え皮下組織の剥離をしないように筋膜を切開し、深部は筋膜より1cmほどの筋肉・一部骨も含めて切除した。術中に深部より腫瘍の位置を確認し、腫瘍直下は筋肉も併せて切除した。直径25cmの皮膚欠損を認め、advance flapにて再建し被覆・縫合して終了とした。
病理所見
皮下結合織、一部筋層表層部まで広がる約10X10X3cm大の腫瘤を認め、核の腫大、大小不同、濃染化、核分裂像が散見され、奇異な大型核を示す異型紡錘形細胞や類円形や短紡錘形の組織球様細胞、異型多核巨細胞の増生を認めた。異型紡錘形細胞の花むしろ状配列や間質の粘液浮腫性変化、巨細胞の増生が優位な部分、壊死性変化、炎症性細胞浸潤など多彩な像が認められた。一部に筋肉内浸潤している部分を認めたが、筋肉を合併切除することにより断端に腫瘍細胞を認めず、切除縁は広範切除であった。
考察
軟部腫瘍は筋肉、脂肪、神経、血管周囲組織などの非上皮性組織より発生する腫瘍で、原則的に組織起源に基づいて分類される。大きさが5cm以上、深部発生、可動性がない、圧痛がある、硬い等を認める場合は悪性を強く疑う。悪性軟部腫瘍の治療は腫瘍の組織学的gradeにより決定され、病期分類はEnneking分類が一般的に使用されている。
Enneking分類
| 病期 stage | 悪性度 grade | 腫瘍の局在 site |
|---|---|---|
| ⅠA | 低悪性 | 腫瘍が区画内に限局 |
| ⅠB | 低悪性 | 腫瘍が区画外に拡大 |
| ⅡA | 高悪性 | 腫瘍が区画内に限局 |
| ⅡA | 高悪性 | 腫瘍が区画外に拡大 |
| Ⅲ | 悪性度に関係なし | 腫瘍の局在に関係なく遠隔転移あり |
悪性軟部腫瘍は人口10万あたり約2.0人で、小児では頭頸部領域に発生するものが多く、成人では四肢や後腹膜発生のものが多い。小児では横紋筋肉腫(頭頸部・大腿部に好発)、成人ではMFH(大腿部に好発)と脂肪肉腫(後腹膜に好発)が多い。大部分の肉腫は発生頻度に性差はなく、発生年齢により腫瘍の組織型に特徴がある。悪性軟部腫瘍は一般的にリンパ節転移を起こしにくく、肺への血行性転移が多い。
悪性軟部腫瘍の組織型別頻度・好発年齢・好発部位
| 悪性線維性組織球腫 | 26.3% | 50〜70歳 | 下肢・上肢・体幹 |
| 脂肪肉腫 | 22.9% | 40〜60歳 | 下肢・後腹膜・体幹は避け |
| 滑膜肉腫 | 9.7% | 30〜50歳 | 下肢・上肢 |
| 横紋筋肉腫 | 6.9% | 0〜20歳 | 頭頸部・下肢・その他 |
| 悪性神経鞘腫 | 6.8% | 20〜40歳 | 下肢・上肢・頭頸部 |
| 平滑筋肉腫 | 6.3% | 50〜70歳 | 後腹膜・下肢 |
組織学的診断のために生検が必要で針生検と切開生検が一般的である。吸引細胞診で良性・悪性を診断することもあるが正診率に問題がある。針生検は簡便であるが材料不足により確実な診断が困難なことがあり、表在性の腫瘍では切除生検が行われることが多い。針生検、切開生検のいずれでも腫瘍によって周囲組織は汚染されるため広範切除を想定した皮切により侵入し、周囲組織を汚染させない配慮が必要である。また、横皮切は筋組織等の腫瘍汚染層を広げるため禁忌とされ、四肢では皮膚や軟部組織の再建が容易なコンパートメントに対して長軸に沿って皮膚切開を加える。侵入経路として神経血管の近傍は避け、広範切除の際に生検創は腫瘍と一緒に合併切除する。組織学的診断のためにはHE染色が基本となる。免疫組織学的染色法(酵素抗体法)は鑑別に有用なものもあるが、必ずしも特異的ではなくあくまでも病理組織診断の補助として用いられる。
軟部腫瘍の免疫組織化学
| 抗原 | 染色される組織 | 染色される腫瘍 |
|---|---|---|
| ビメンチン | 間葉系 | ほとんどの軟部腫瘍 |
| サイトケラチン 上皮膜抗原 | 上皮性 | 類上皮肉腫 滑膜肉腫 中皮腫 |
| デスミン ミオグロビン アクチン | 筋原性 | 平滑筋肉腫 横紋筋肉腫 |
| 第Ⅷ因子 | 血管性 | 血管肉腫 血管内皮腫 |
| S-100蛋白 | 神経原性 軟骨性 | 悪性神経鞘腫 軟骨肉腫 |
転移のない軟部悪性腫瘍の最も重要な治療は原発巣の根治的切除術である。小児の横紋筋肉腫、Ewing肉腫は化学療法の奏効率が高いため、術前化学療法により切除範囲の縮小が可能になることがある。放射線単独治療は腫瘍が切除不可能な場合や患者の状態により手術が行えない場合などに用いられてきたが、近年重粒子治療が骨盤悪性腫瘍など切除不可能な症例に対して行われるようになり、広範切除と同等の治療成績をあげている。
腫瘍実質内を切除縁が通過するものを腫瘍内切除(intralesional excision),腫瘍を被膜部あるいは反応層部一塊として切除するものを腫瘍辺縁切除(marginl excision)(局所再発率60%),腫瘍を反応層外の健常組織で被包し、一塊として切除するものを広範囲切除(wide excision)(局所再発率20%),腫瘍反応層からの距離がホルマリン固定による収縮を補正した値で5cm以上、またはそれに相当する厚さの健常組織で被包し、一塊として切除するものを治癒的(広範)切除(curative excision)(局所再発率4%)という。反応層とは腫瘍の膜様組織とその周囲の出血巣、変色した筋肉、浮腫状の組織など肉眼的な変色部を指し、切除縁評価に際しては腫瘍とみなす。悪性軟部腫瘍ではwide excision あるいは curative excision を行う。wide excision縁では健常な組織の厚さによって根治性に差があり、腫瘍からの距離が離れるほど根治性は高いが、術後機能は低下する。腫瘍周囲には筋膜、関節包、腱鞘、血管外膜、神経上膜など腫瘍浸潤に対して抵抗性を示す組織=barrierが存在する。このbarrierは腫瘍から切除線までの距離に換算することが可能であり、これを利用することで切除範囲を縮小できる。局所再発率10%以下を適切な切除縁とすると、浸潤傾向に乏しい高悪性肉腫では2cm相当以上の健常組織を付けての切除、低悪性肉腫では1cm相当以上の健常組織を付けての切除が適切な切除縁となる。手術単独で適切な切除縁の確保が難しいときに化学療法、放射線治療等が併用される。
患肢温存手術に際しては、腫瘍が神経・血管束に近接している場合が問題となる。
腫瘍が血管・神経に近接し、安全な切除縁の確保が難しい場合の選択肢として術前療法がある。術前療法により腫瘍が縮小して、腫瘍との間に正常組織が認められる様になれば患肢温存が可能になる。術前療法には化学療法と放射線療法がある。軟部肉腫は、化学療法に対する感受性から、円形細胞肉腫と非円形細胞肉腫に分けられる。化学療法は放射線療法に比較すると奏効率は低いが、有効であれば繰り返し行うことによりさらに効果を上げることが可能であり、また全身の微小転移に対する治療もおこなえるという利点がある。円形細胞肉腫は横紋筋肉腫や骨外性Ewing肉腫等の組織学的に小円形の肉腫細胞からなる腫瘍であるが、化学療法の有効性が確立しており、それぞれに適したレジメンが標準治療となっている。骨外性Ewing肉腫は骨原発のEwing肉腫と同じ治療が行われ、vincristine,doxorubicin,cyclophosphamide,ifosfamide,etoposideの交代療法が推奨されている。横紋筋肉腫小児例では転移の有無や発生部位などでリスク分類が行われ、リスク別に治療レジメンが規定されている。整形外科領域で扱う四肢発生の横紋筋肉腫は、ほとんどが中間リスク群に相当し、vincristine,actinomycin D,cyclophosphamide 3剤によるレジメンが標準化学療法とされている。一方、非円形細胞肉腫は紡錘形や多形性の細胞からなる平滑筋肉腫、MFH、滑膜肉腫等の軟部腫瘍が挙げられる。円形細胞肉腫よりもはるかに発生頻度は高いが化学療法に対する感受性は低く、その有効性についてはいまだcontroversialな状況である。doxorubicin単剤を超える治療成績を示したレジメンが報告されておらず、軟部肉腫進行例に対してはdoxorubicin単剤が標準治療に位置づけられている。近年、高悪性度非円形細胞肉腫の四肢発生例に対してdoxorubicinおよび、ifosfamideによる補助化学療法の有用性が示されている。
放射線療法は、根治的放射線療法、補助的放射線療法、緩和的放射線療法、重粒子線治療に分類される。放射線療法は副作用が少なく、高齢者でも安全に行える利点があり、悪性軟部腫瘍に対しては主として補助的放射線療法がおこなわれている。術前照射は切除縁を縮小するために術前に単独あるいは化学療法と組み合わせて行う。放射線療法単独の場合は50Gy前後を5週間程度で照射することが多い。術前照射の長所は術後照射に比べて照射野の設定が容易なため照射野を縮小し、また線量を少なくできる、手術による腫瘍細胞の低酸素状態を避け、放射線感受性低下の影響を軽減できることである。短所は創治癒合併症の頻度が高い、放射線の影響により病理診断が困難になる、適切な切除時期を失する可能性があるなどである。術後照射は広範切除を行ったが病理組織学的に十分な切除縁が得られていないinadequate wide excisionの症例やintralesion excisionの症例に50~60Gyを5~7週間で照射する。術後照射の長所は時期を失することなく切除できる、病理診断が十分に可能、創治癒合併症が術前照射より少ないなどである。短所は術前照射に比べ照射野が拡大する、手術の影響で照射野が低酸素状態となり放射線感受性が低下するなどがあげられる。小線源療法は腫瘍切除後の腫瘍床や神経・血管束に留置したチューブ内に、192Ir高線量率ラルスを用いて192Ir線源を移送することにより線量分布を制御して照射する。高悪性腫瘍が適応で、低悪性度腫瘍や肉眼的残存腫瘍は適応外である。術後早期(5~7日)に治療を開始し、45~50Gyを5日間で照射する。長所は線量分布の最適化が可能で健常組織の不必要な照射を避けることができる、外部照射後再発例に対しても再度照射が可能である、術後早期に治療を開始するために低酸素状態を回避できるのでより効果的、短期間で治療が終了する、治療コストが軽減できるなどが挙げられる。短所は特殊な装置が必要、切除縁陽性の場合は外部照射の追加を要する、創治癒合併症の可能性などがあげられる。外部照射と治療成績はほぼ同等(5年生存率70%、局所制御率84%)、創治癒不全(12%)や神経障害(5%)などの合併症も外部照射と差はないとされている。補助的放射線療法として腫瘍切除と同時に電子線や小線源による術中照射を組み合わせて局所制御を図ることもある。術中照射は神経・血管束が腫瘍に近接し、marginalかinadequate wide marginとなる場合に行われる。重粒子線治療は炭素などのイオンを超高速に加速した粒子線を用いた放射線治療で、線量の集中性と生物学的効果において優れた特徴を持つ。切除不能な骨軟部肉腫に対する局所制御率は1年で88%、3年で73%とされ皮膚障害以外の重篤な副作用は少ない。
悪性軟部腫瘍全体の5年生存率は約50%とされるが組織型やその亜型により予後は大きく異なる。遠隔転移は殆どが肺であるが、単発性や少数の肺転移巣積極的に切除され、時には治癒が得られる。
血管再建は自家血管移植や人工血管移植がある。大伏在静脈を利用した自家血管移植は人工血管移植に比べて感染に強く、開存率が高いという利点があるが、健常部に新たな傷ができるという欠点がある。大きな軟部欠損に加えて、主要な動静脈を切除した場合、動脈の再建に加えて静脈を再建したほうが安全である。主要な静脈の再建がなければ患肢の静脈圧は上昇し、移植した動脈を閉塞する危険があるからである。静脈の再建を省けるのは、静脈がすでに腫瘍により閉塞していて側副路ができており、しかも軟部の欠損が少ない場合である。骨を全周に渡って切除した場合には、自家骨移植、切除した骨を熱や放射線により処理して戻す方法、人工関節など金属材料で補てんする方法などがある。
皮膚を大きく切除した場合には、植皮や皮弁形成が必要となる。皮弁には局所皮弁と遊離皮弁がある。皮膚と皮下組織からなるものを皮弁、深層筋膜を含めた皮弁を筋膜皮弁、さらに筋肉を含めて挙上する皮弁を筋皮弁という。皮弁移植の第一選択は局所皮弁で、遊離皮弁は最終選択である。深部から皮膚へと至る血管は深層筋膜に達したのちに血管網を形成し、皮下脂肪組織を経て真皮下血管網を形成している。深層筋膜から皮膚へと向かう血管(穿通枝:perforator)により養われる皮弁を穿通枝皮弁という。局所皮弁の移動方法として前進皮弁、横転皮弁、回転皮弁などがある。一方、皮弁などで修復できない大きく複雑な欠損の再建には血管吻合を伴う血管柄付遊離皮弁移植が選択される。合併症として皮膚壊死が挙げられる。皮弁壊死を防ぐためには、緊部を緩く縫合すること少しでも皮弁の色調が不良の際は皮弁を縫合している糸を外し皮弁の血流を確保する処置が必要である。
悪性線維性組織球腫 MFH
多形性を示す組織球様細胞と紡錘形線維芽細胞よりなる。組織学的に多形型、粘液型、巨細胞型、炎症型の亜型に分類される。現在は悪性軟部腫瘍の中でももっとも頻度の高い腫瘍であるが、免疫組織化学や分子生物学手法による組織起源の検索が進むにつれ、本診断は減少している。50〜70歳台に最も多くみられ、下肢・臀部の筋肉内などの深部に多く発生するが、皮下など表在性に発生するものもまれではない。炎症性亜型ではCRPの著しい上昇を伴う炎症所見を呈することがある。出血壊死を伴うことが多いため、CT・MRIで強い不規則陰影や信号を呈する。腫瘍細胞は異型性が強く、核分裂も多くみられ、多核の異型巨細胞が存在する。典型的には花むしろ多形を呈する。粘液型は粘液腫状の部分が腫瘍の半分以上を占めるものをいう。巨細胞型は多数の破骨細胞型巨細胞が出現する。炎症型は組織球性の腫瘍細胞に混じって強い好中球の浸潤を有する。治療は広範切除が原則であり、放射線療法を併用することもある。高悪性度の組織像を呈する症例では化学療法を行う。予後は組織学的悪性度と腫瘍の大きさに依存し、5年生存率は50~60%である。転移は肺に最も多く、進行例ではリンパ節、肝、骨にもみられる。




